Pro tuto chvíli necháme bez povšimnutí závorky, které jsme použili u termínu „v plynné fázi“ a věnujeme se určení rychlostní rovnice této hydrogenace. Cílem je nalézt prostředek pro stanovení axiálního profilu aktivity katalyzátoru, což pak umožní modelovat průběh dezaktivace v průběhu hydrogenačního cyklu.
Experimentální postup stanovení kinetiky spočívá ve změně parametrů procesu: nástřik, molární poměr plyn/ nitrobenzen, teplota, tlak, koncentrace vodíku ve směsi vodíku a dusíku. V průběhu katalytického cyklu po několika desítkách hodin, kdy se režim stabilizuje, přistoupíme ke změnám parametrům a po jisté době (1,5 hodiny) zaznamenáme teplotní profily s odstupem 30 minut. Takováto série krátkodobých pokusů, z nichž každý trval celkem 2 hodiny, je v tabulce 4.1.
Tabulka 4.1: Krátkodobé pokusy během cyklu č. 20, hodiny 312 – 326
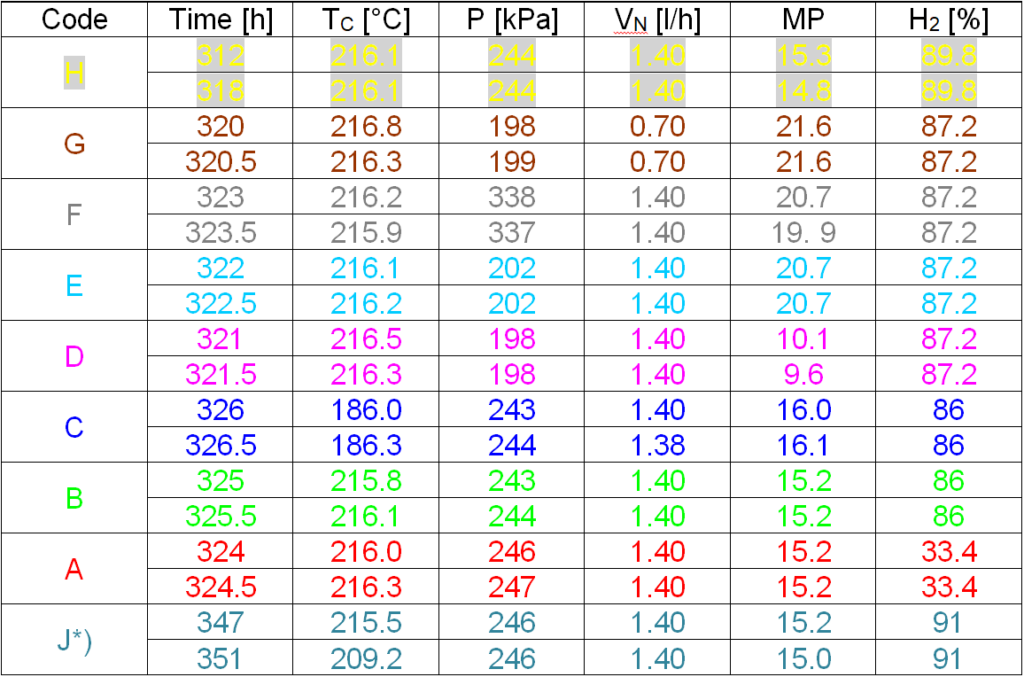
MP Molární poměr plynů k nitrobenzenu na vstupu do reaktoru
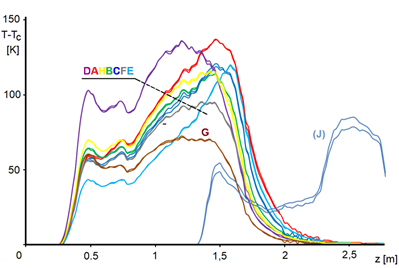
Teplotní profily naměřené během krátkodobých pokusů z tabulky 4.1 jsou na obrázku 4.1.
Opakujeme cíl: již umíme spočíst profil rychlosti na základě teplotního profilu, nyní se snažíme určit pokles profilu aktivity v čase. Nejjednodušší je pokusit se stanovit aktivitu jakožto rychlostní konstantu v rovnici typu
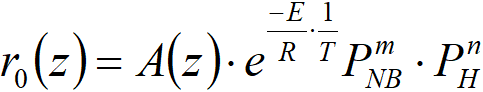
r0(z) rychlost reakce na souřadnici z, mol.m-3s-1
A(z) aktivita katalyzátoru na souřadnici z
E/R zdánlivá aktivační energie vs. plynová konstanta
m řád reakce vůči nitrobenzenu
n řád reakce vůči vodíku
Jeden z mých kolegů kdysi publikoval výsledek:
Pexidr V.,Heral V., Chemický průmysl 33, 229 (1983).
Rovnice byla
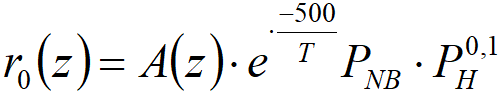
Abychom neopakovali měření již publikovaná, zobrazíme zde použití rovnice [4.2] na novější měření, sérii z obrázku 4.1.
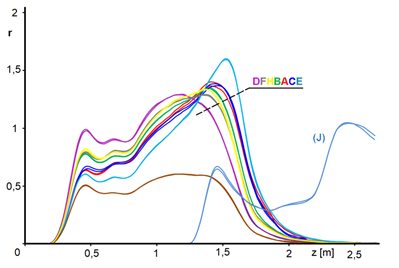
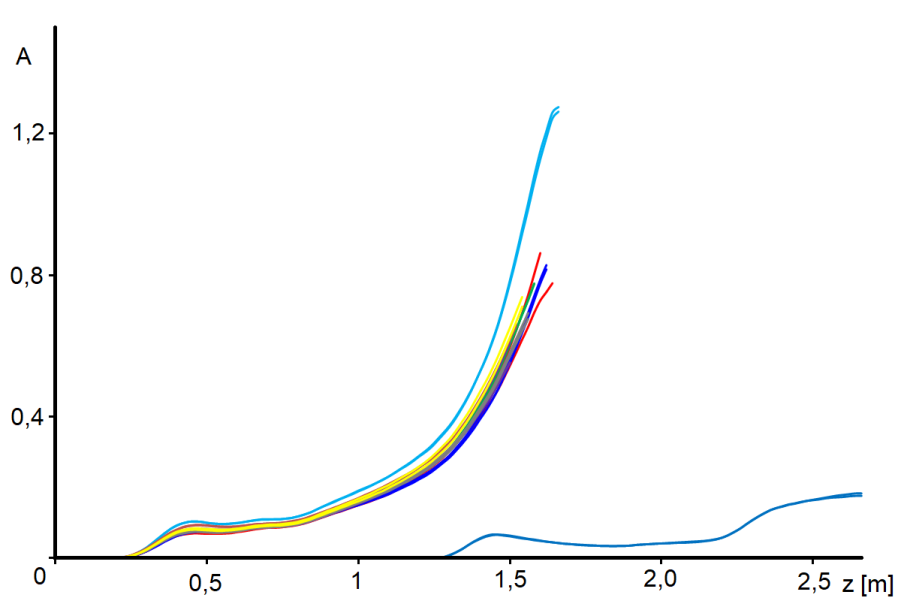
Na obrázku 4.3 jsme křivky uťali při stupni přeměny 0,9, neboť pro vyšší konverzi se křivky aktivity stávají příliš nejistými – konstatujeme zázračný nárůst aktivity ke konci profilu. To je ale evidentně nemožné. Navíc jsme provedli tento pokus: odebrali jsme počáteční část katalytického lože, abychom reakční směsi nabídli čerstvý katalyzátor – viz obrázek 4.1, křivka [J]. Konstatujeme, že ačkoli úsek reaktoru za souřadnicí 1,5 ještě nezpracoval prakticky žádný nitrobenzen, katalytická náplň je zde již značně desaktivována. Předpokládáme, že v této oblasti, kde jsou teploty relativně nízké, usazují se vedlejší látky vzniklé v reakční zóně a že tyto nečistoty jsou ve formě viskózní kapaliny. Je docela možné, že tyto nečistoty postupují dál mechanismem, podobným chromatografii GLC.
V případě hydrogenace nitrobenzenu zde tedy máme skutečnou „stacionární“ kapalnou fázi, která omezuje přístup reakčních složek k povrchu a z povrchu. Takže i když jde o „hydrogenaci v plynné fázi“, reakce se ve skutečnosti odehrává přes kapalný film. Povšimněme si také poměru E/R = 500 v rovnici [4.2]; takováto hodnota je typická pro přenos hmoty, zatímco aktivační energie vlastní chemické reakce musí být řádově E/R = 5000 (neboli 10 kcal∙mol-1). My jsme během dvou katalytických cyklů (HC20 a HC21) realizovali 6 sérií krátkodobých pokusů a výsledek byl vždy stejný: závislost rychlosti hydrogenace na teplotě je prakticky zanedbatelná.
Jistým důkazem existence onoho laminárního filmu – nejspíš spojeného s termínem „kapilární kondenzace“ – dává také detailní analýza našich teplotních křivek. Na obrázku 4.4 zobrazujeme rychlost na souřadnici z=1 m v závislosti na čase pro naši sérii měření:
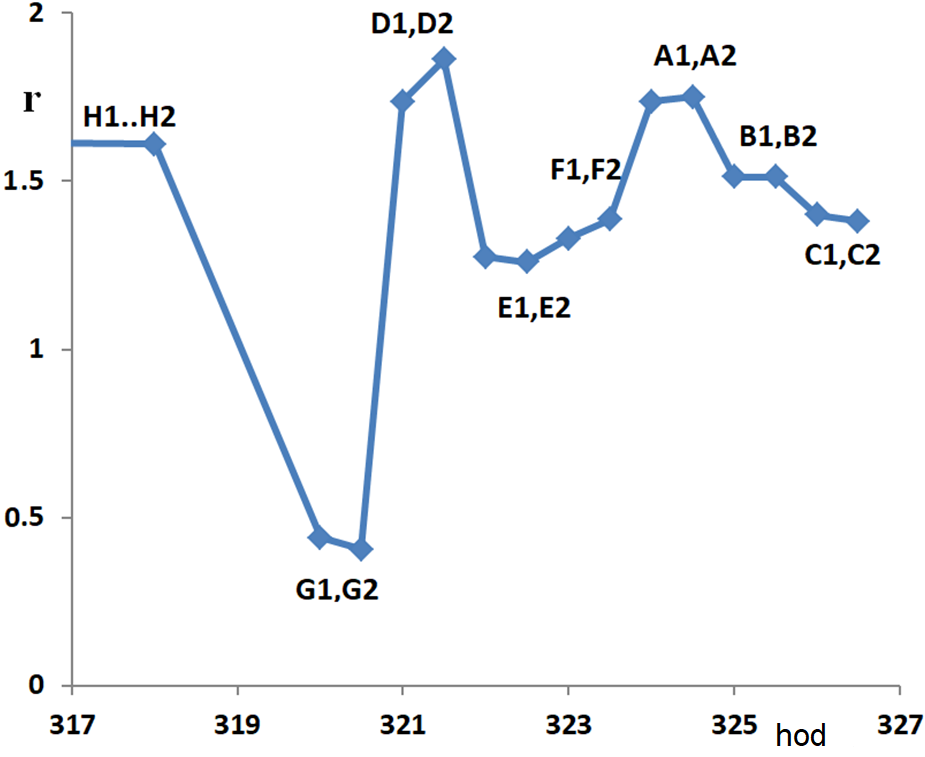
Vezměme kupříkladu bod G2, hodina 320,5. Poté co jsme naměřili teplotní profil G2 a provedli jsme změnu parametrů, bylo po 90 minutách provedeno měření D1 a po dalších 30 minutách měření D2. Vidíme, že mezi 90. a 120. minutou od změny parametrů se rychlost ještě mění ve směru změny, jinak řečeno, ustavení nové rovnováhy na povrchu není dvě hodiny od změny parametrů ještě skončeno.
Podle našich zjištění rychlost hydrogenace nitrobenzenu v plynné fázi je prakticky nezávislá na teplotě a na tlaku vodíku. Je úměrná parciálnímu tlaku nitrobenzenu či nepřímo úměrná parciálnímu tlaku produktů hydrogenace (voda, anilín). Reakce probíhá přes kapalný film.
Závěrem
Tyto texty byly věnovány teorii a praxi heterogenní hydrogenace. Pokud se nám podařilo tuto techniku alespoň zčásti zbavit tajemnosti, pak naše práce splnila účel.
Zkratky a symboly
AN anilín
A(z)—–aktivita katalyzátoru na souřadnici z
aR——-aktivita olefinu na katalytickém povrchu
aH aktivita atomárního vodíku na katalytickém povrchu
α———rozpustnost vodíku
[A]T ———–celkový počet aktivních míst povrchu
[A]—————aktivní místa neobsazená
[A.R]T ———–celková koncentrace struktur s olefinem, A.R a A.R.H2
[A.R.H2] aktivní místa obsazená obsazená „na dvě patra“ olefinem a vodíkem
[A.H]T aktivní místa obsazená atomárním vodíkem (A.H, A.H+)
[A.H2]T aktivní místa obsazená molekulárním vodíkem (A.H2, A.HH)
C celková tepelná kapacita systému, kJ∙K-1
c koncentrace hydrogenované látky
cp——-střední tepelná kapacita, kJ.mol-1K-1
c1, c2 koncentrace vodíku v roztoku
cH0 rozpustnost vodíku v reakční směsi
cS koncentrace vodíku u katalytického povrchu
Cat—–katalyzátor
E zdánlivá aktivační energie
G hmotový tok na jednotku průřezu lože, mol∙s-1m-2
H Henryho konstanta
∆H reakční entalpie, kJ.mol-1
k celkový koeficient přenosu tepla v bilanci [2.12], kJ∙K-1∙s-1
K——–chladicí konstanta reaktoru, s-1
Ki konstanty adsorpčních rovnováh (KR, KH, KH2, KRH2)
k, ki — rychlostní konstanta
k1 rychlostní konstanta v rovnici 2.5
kD difuzní konstanta
KD celkový koeficient transportu hmoty
kV rychlostní konstanta chemické reakce
m řád reakce vůči nitrobenzenu
MP molární poměr plyn/nitrobenzen na vstupu do reaktoru
n řád reakce vůči vodíku
nH celková spotřeba vodíku, mol
n0 nástřik nitrobenzenu na jednotkový průřez lože, mol.s-1m-2
nNB celkový nástřik nitrobenzenu, kg∙hod-1
NB nitrobenzen
ND—–celkový koeficient přenosu hmoty
PH——parciální tlak vodíku v plynné fázi
Pi aktivita složky (i) v plynné fázi
PS ——efektivní tlak vodíku (jeho aktivita) u povrchu katalyzátoru
r rychlost hydrogenace
rkin—–rychlost hydrogenace za kinetických podmínek
rD——rychlost transportu hmoty
r0(z) rychlost reakce na souřadnici z, mol.m-3s-1
RV převrácená hodnota rychlostní konstanty
R——–substrát – hydrogenovaná látka
RH2 redukovaný substrát
t čas, s
T———-teplota, K – stejně tak T1, T2, T3
TC teplota přenašeče tepla, K
ΔTAD adiabatický teplotní rozdíl, K
ΔTEF efektivní adiabatický teplotní rozdíl, K
TE teplota na vstupu do katalytického lože, K
TF teplota na výstupu katalytického lože, K
T(0) počáteční teplota (pro x=0)
T(t) konečná teplota
U koeficient přenosu tepla na jednotku délky katalyzátoru, kJ.s-1K-1m-3
VN nástřik nitrobenzenu, litry/h
W navážka katalyzátoru, g
WD váhový koeficient
x stupeň přeměny (konverze)
x(t) celková konverze
xF stupeň přeměny na výstupu z lože
z axiální souřadnice lože, m